Британские ученые получили разрешение на модификацию генома человеческого эмбриона. Об этом 1 февраля объявило Управление по оплодотворению и эмбриологии человека (HFEA), контролирующее процессы искусственного оплодотворения. Это первый в истории акт официального одобрения регуляторами подобного обязательства.
"Это чрезвычайно важно. HFEA (…) создал прецедент, который позволит процветать этому типу исследований", — говорит Джордж Дейли из Детской больницы Бостона, штат Массачусетс.
Организация удовлетворила заявку врача из Института Фрэнсиса Крика в Лондоне, разрешив использовать технологию генной модификации CRISPR на здоровом человеческом эмбрионе. Команда под руководством доктора Кэти Ниакан заинтересована в изучении генов, которые становятся активными в первые несколько дней после оплодотворения женской яйцеклетки. Команда планирует внести изменения только в эти гены и работать над ними в течение семи дней подряд, после чего эмбрионы будут уничтожены, а эксперимент прекращен.
Это решение также наверняка подбодрит других биологов, которые надеются заняться исследованиями в области редактирования генома человека. По словам Робин Ловелл-Бэдж из FCI, она надеется, что после этого знаменательного решения в HFEA начнет поступать больше заявок с предложениями по проведению исследований.
"В других странах это решение также должно дать ученым смелость обратиться в свои национальные регулирующие органы за разрешением на проведение исследований, если оно у них есть".
Команда Niakan получила лицензию на проведение исследований на здоровых человеческих эмбрионах, которые жертвуют пациенты клиник по лечению бесплодия. Заявка на одобрение поступила в HFEA через пять месяцев после того, как китайские ученые использовали технологию CRISPR-Cas9 для редактирования генома "поврежденных" человеческих эмбрионов.
Первый эксперимент будет включать в себя блокирование активности гена, называемого "главным регулятором" Oct4, который активен в клетках развивающегося плода (m. в клетках, подвергающихся трансформации для производства плаценты). Команда планирует завершить эксперименты с образцами в течение недели после оплодотворения, когда эмбрионы содержат от 64 до 256 клеток и называются стадией бластоцисты.
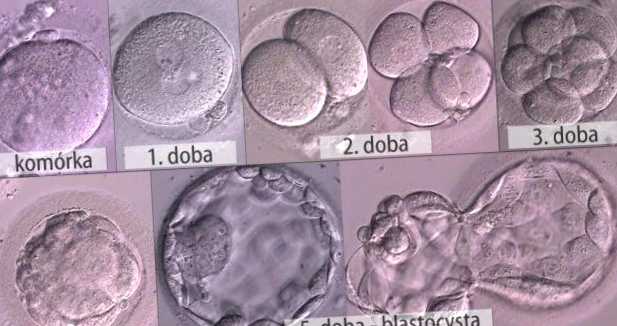
Источник: tvn24.en
"Этот шаг Великобритании будет стимулировать дебаты о правовом регулировании и разграничении редактирования зародышевой линии в клинических условиях", — комментирует Тецуя Исии, биоэтик из Университета Хоккайдо в Саппоро, который отмечает, что в некоторых странах нет прямого запрета на вмешательство в репродуктивные механизмы, достаточно.
"Подобные исследования должны оказаться ценными для понимания многих сложных вопросов, связанных с редактированием зародышевой линии", — добавляет Дейли. "Хотя эта работа не направлена на клиническое применение, она может многому научить нас о потенциальных рисках такого применения".
Генетические модификации могут помочь ученым в разработке методов лечения бесплодия, но само по себе изменение генотипа никогда не станет основой терапии.

